聯(lián)系我們
廣州市黃埔大道西613號
020-38688888
510630
當(dāng)前位置:首頁 > 本院動態(tài)
NatureMedicine(IF:82.9),!暨南大學(xué)附屬第一醫(yī)院/基礎(chǔ)醫(yī)學(xué)與公共衛(wèi)生學(xué)院李揚秋研究員團(tuán)隊有關(guān)肺癌罕見基因變異的創(chuàng)新性研究成果正式發(fā)表
發(fā)布者:系統(tǒng)主管 發(fā)布時間:2023/07/24
2023年7月24日,,暨南大學(xué)附屬第一醫(yī)院/基礎(chǔ)醫(yī)學(xué)與公共衛(wèi)生學(xué)院李揚秋研究員團(tuán)隊劉思陽博士后與廣東省人民醫(yī)院吳一龍教授團(tuán)隊合作,于國際醫(yī)學(xué)頂刊雜志Nature Medicine(IF:82.9)上發(fā)表了題為“First-line pyrotinib in advanced HER2-mutant non-small-cell lung cancer: a patient-centric phase 2 trial”的臨床試驗結(jié)果文章,,公布了大型傘式研究(CTONG1702)第七個臂組(HER2-arm)的研究結(jié)果和同期開展的觀察性真實世界研究(CTONG 1705)的部分?jǐn)?shù)據(jù)結(jié)果,。該研究首次提出了一種針對罕見基因變異受試者的全新臨床試驗?zāi)J?/strong>,,擴(kuò)展入組標(biāo)準(zhǔn),,避免非必要的排除標(biāo)準(zhǔn),,增加了研究藥物治療更廣泛患者人群的療效和安全性數(shù)據(jù),,同時也觀察了真實世界中接收臨床常規(guī)治療的患者臨床結(jié)局。為全面收集少見驅(qū)動基因變異患者的研究數(shù)據(jù),、探索最合理的治療方案開創(chuàng)了一種更加高效的臨床研究設(shè)計思路,。
該研究的第一作者是暨南大學(xué)附屬第一醫(yī)院的劉思陽(Si-Yang Maggie Liu)博士后,該研究是她博士在讀期間就已經(jīng)開展的研究工作,,劉博士表示:“本研究在2017年開始設(shè)計,,2018年啟動,到今年已經(jīng)是第6年了,,這個大型傘式研究的一個臂終于開花結(jié)果,。臨床試驗本身是一種通過嚴(yán)格篩選,使符合入組條件患者有機(jī)會接受最前沿的,、未上市藥物治療的研究模式,。但是據(jù)統(tǒng)計,只有不到一半的患者有機(jī)會參加臨床試驗,,而這其中又有近一半的患者因為入組標(biāo)準(zhǔn)等限制而被排除在外,。嚴(yán)格的入組標(biāo)準(zhǔn)保證了一批條件基本相似的人群接受相同的藥物治療,,其結(jié)果因為條件基本一致使藥物療效可信度很高。但過度嚴(yán)格的條件不僅會限制患同一癌癥的部分患者接觸研究藥物治療,,其研究結(jié)果也往往無法代表真實世界廣大癌癥患者的療效和安全性,。在生物標(biāo)志物驅(qū)動治療的時代,由于罕見突變的發(fā)生率較低,,攜帶這類基因變異的患者數(shù)量有限,,極大的延長了靶向藥物的研發(fā)周期,使得患者長時間不能接受可能有效的靶向藥物,,臨床試驗是這類患者接觸最前沿藥物的寶貴機(jī)會,。”
本研究的通訊作者之一為暨南大學(xué)血液研究所所長李揚秋研究員,,她高度評價了本研究的設(shè)計創(chuàng)新性:“深化以患者為中心的臨床試驗(可以在臨床試驗開的各個階段(包括設(shè)計,、啟動、入組,、數(shù)據(jù)收集,、結(jié)束和結(jié)局報告)中優(yōu)先考慮患者需求。然而,,目前的PCT主要是通過數(shù)字技術(shù),,如遠(yuǎn)程醫(yī)療、遠(yuǎn)程監(jiān)測,,提高患者參與研究的機(jī)會或者提高患者體驗,,很少涉及研究整體的設(shè)計。本研究是第一個從研究設(shè)計角度,,深化PCT概念的臨床試驗,,為以后罕見靶點的臨床研究提供了一個非常好的案例,對未來靶向藥物研發(fā)設(shè)計將帶來極大的影響力,?!?/span>
研究成果介紹:
(1)研究設(shè)計:本研究同時啟動了一項由研究者發(fā)起、以患者為中心的II期大型傘式研究(CTONG1702)和一項觀察性真實世界研究(CTONG 1705),?;颊咄ㄟ^中心實驗室的大隊列二代測序檢測,富集具有罕見基因變異的非小細(xì)胞肺癌患者,,并根據(jù)其檢測結(jié)果決定進(jìn)入哪一個子研究,。符合CTONG1702研究的嚴(yán)格入組標(biāo)準(zhǔn)的患者將進(jìn)入嚴(yán)格入排隊列;而攜帶罕見靶點,、但不符合入組標(biāo)準(zhǔn)的患者,,通過同情用藥的方式進(jìn)入研究,定義為同情用藥隊列。主要目的是看看研究藥物對這些人群的有效性安全性,。除此之外,,因各種原因未入組CTONG1702研究的、但攜帶罕見靶點的患者進(jìn)入觀察性真實世界研究隊列,,接受臨床常規(guī)治療,,以觀察這部分患者的臨床結(jié)局(圖1)。
HER2突變在NSCLC中的發(fā)生率為2-4%,,目前尚未有獲批的一線治療的靶向藥物,。吡咯替尼是一種靶向該基因靶點的藥物,在中國已被批準(zhǔn)用于HER2陽性乳腺癌,。此次文章發(fā)表報道了初治HER2突變型晚期NSCLC患者接受吡咯替尼的療效和安全性,,以及接受常規(guī)治療的臨床結(jié)局。
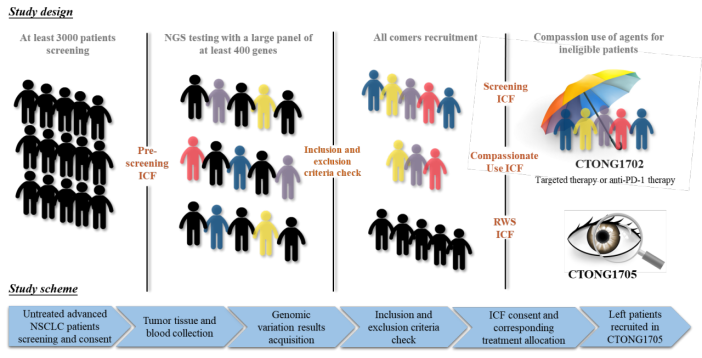
圖 1 CTONG1702和CTONG1705研究設(shè)計
(2)研究結(jié)果:
截至2021年12月,,研究共篩選出48例HER2突變型晚期初治肺癌患者其中嚴(yán)格入組隊列28例,,吡咯替尼有效率為35.7%。中位疾病不復(fù)發(fā)時間為7.3個月,,中位總生存為14.3個月,;同情用藥12例,有效率為16.7%,,疾病不復(fù)發(fā)時間為4.7個月,,中位總生存為14.2個月;而在真實世界接受常規(guī)治療的,,無一例有效,,無復(fù)發(fā)時間只有3.個月。
在藥物安全性方面,,正如預(yù)期的一樣,,嚴(yán)格入排隊列大于等于3級的嚴(yán)重副作用比較少,只有10.7%的發(fā)生率,,而同情用藥組嚴(yán)重副作用幾乎翻了兩倍,達(dá)到33.3%,,但這兩組中均沒有因為副作用需要永久停藥的,。副作用基本和其他靶向藥物的副作用類似,容易處理,。
總之,,本研究是首個在同一時間段內(nèi)入組、但又是非直接比較的,、能夠全面顯示一個藥物在同一個靶點上的有效性和安全性的研究,,也和不接受精準(zhǔn)靶點治療的人群有了間接的比。這為以后罕見靶點的臨床研究提供了一個案例,也為全面評價一個研究藥物提供了全新的角度,,其前瞻性和實用性非常強(qiáng),。

全文鏈接: https://www.nature.com/articles/s41591-023-02461-x
文:劉思陽
供稿科室:科研科
責(zé)編:董思妤
初審:羅志權(quán)
復(fù)審:尹海燕
終審發(fā)布:張水興

 粵公網(wǎng)安備 44010602002443號
粵公網(wǎng)安備 44010602002443號


