聯(lián)系我們
廣州市黃埔大道西613號
020-38688888
510630
當前位置:首頁 > 本院動態(tài)
我院趙建夫/尹海燕/陳填烽在納米藥物逆轉(zhuǎn)肺癌放療抵抗上取得新突破
發(fā)布者:系統(tǒng)主管 發(fā)布時間:2023/03/27
近日,,暨南大學附屬第一醫(yī)院趙建夫/尹海燕/陳填烽團隊在構建新型納米藥物克服肺癌放射抗性的治療上取得重要進展,,相關研究成果“Reversing lung cancer radioresistance by hyperpermeable tellurium nanotherapeutics via remodeling tumor microenvironment”發(fā)表在國際著名期刊Nano Today (IF=18.962),。暨南大學附屬第一醫(yī)院為該研究的第一完成單位,,趙鳳芝主治醫(yī)師為本論文的第一作者,,黃煒博士后為本論文共同第一作者,,趙建夫主任醫(yī)師,、尹海燕教授和陳填烽教授為共同通訊作者,。
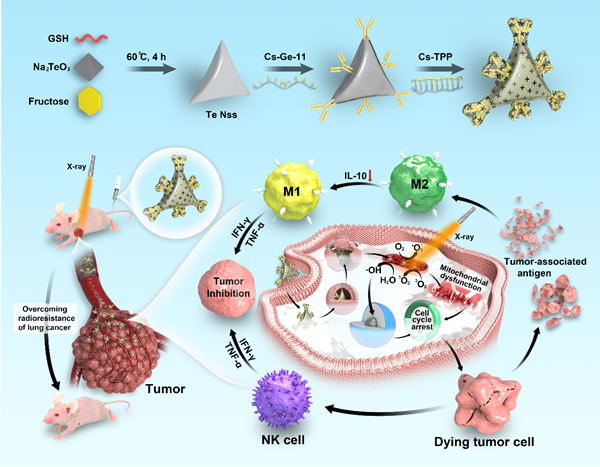
圖1:新型納米藥物通過重塑腫瘤微環(huán)境逆轉(zhuǎn)肺癌輻射抵抗的作用機制。
本單位大量臨床病例研究發(fā)現(xiàn):放療耐受性是肺癌患者放療失敗的主要原因,。因此,,找到有效的靶點和信號通路來逆轉(zhuǎn)放射抗性是治療成功的關鍵所在。腫瘤放射抵抗治療失敗與表皮生長因子受體(EGFR)激活相關,,EGFR下游多個信號通路的激活抵消了放療的療效,,包括對腫瘤細胞增殖、DNA修復,、缺氧和腫瘤轉(zhuǎn)移的影響,。另外,腫瘤細胞在放療后可使EGFR激活,,再次導致放射治療耐受,。同時,放療療效是基于電離輻射產(chǎn)生的高能量促進活性氧(ROS)的形成,,從而誘導癌細胞死亡,,細胞內(nèi)大部分ROS是由線粒體產(chǎn)生?;诖?,針對以EGFR和線粒體為靶點設計放射增敏劑是一種逆轉(zhuǎn)放射耐受性、增強放療療效的潛在策略,。
暨南大學附屬第一醫(yī)院趙建夫/尹海燕/陳填烽團隊通過多學科交叉融合,,一直致力于以臨床問題為導向的化學創(chuàng)新藥物設計與診療應用研究,在基于腫瘤生化特性的靶向藥物設計,、化療增敏,、放療增敏及免疫調(diào)控研究方面作了多年的工作積累?;谖逶兀?,Te)納米材料的優(yōu)良的物理化學性質(zhì)和增敏特性,該項研究以具有高放射增敏能力的碲納米星(TeNSs)為核心,,引導形成EGFR/線粒體雙靶向碲基放射增敏劑(M-TeNSs@Ge-11),。研究發(fā)現(xiàn)該納米體系不僅在肺癌細胞中表現(xiàn)出增加的積累和穿透,,而且增強了放療耐受肺癌細胞對X射線的敏感性,從而通過刺激ROS產(chǎn)生和線粒體功能障礙實現(xiàn)了良好的體內(nèi)外抗癌效果,。此外,,M-TeNSs@Ge-11聯(lián)合X線治療還可以調(diào)節(jié)腫瘤免疫微環(huán)境,通過調(diào)節(jié)M2表型的腫瘤相關巨噬細胞和增強NK細胞浸潤,,進一步增強抗腫瘤活性,。總之,,本研究為EGFR和線粒體雙靶向碲基納米平臺的開發(fā)和逆轉(zhuǎn)肺癌的輻射抵抗提供了一種新方法,,同時為臨床腫瘤精準放射治療提供了新策略,具有較大的臨床轉(zhuǎn)化潛力,,符合國家重大戰(zhàn)略需求,。
上述研究工作得到了國家自然科學基金杰出青年基金、面上項目,、廣東省科技計劃等項目的資助,。
論文鏈接
https://www.sciencedirect.com/science/article/pii/S1748013223000683

 粵公網(wǎng)安備 44010602002443號
粵公網(wǎng)安備 44010602002443號


